Água dura - contém elevadas concentrações de cálcio e de magnésio. Tem origem em solos calcários. Diminui a formação de espuma de um sólido.
Água macia - contém baixas concentrações de cálcio e de magnésio. Tem origem em solos graníticos. Não diminui a formação de espuma de um sabão.
EM PORTUGAL:
Água dura - Regiões do sul e de Leiria
Água macia - Regiões do norte e Madeira
Água média - Regiões do centro e ilha de Porto Santo
sexta-feira, 30 de novembro de 2012
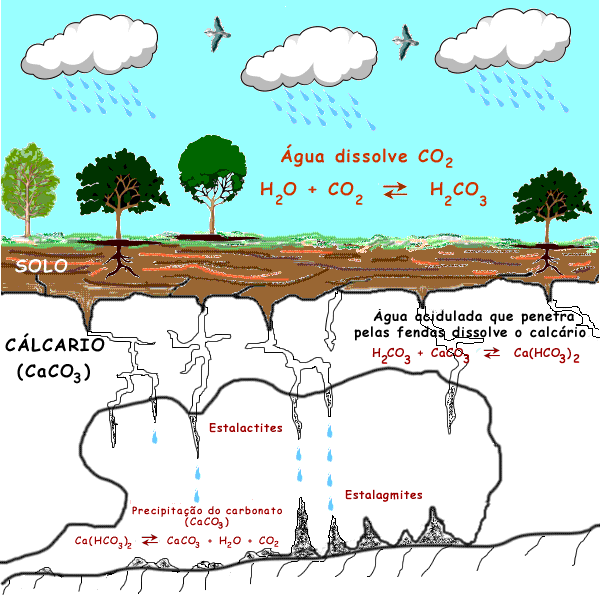
Formação das Estalactites e estalagmites
Formação das estalactites e estalagmites

Estruturas pendentes do teto - estalactites
Estruturas pendentes do solo - estalagmites
Dióxido de carbono no ar dissolve-se na água e forma as chuvas ácidas.
Água da chuva reage com o carbonato de cálcio (constituinte do calcário), na gruta, e forma hidrogenocarbonato de cálcio que fica dissolvido na água.
dióxido de carbono(g) + água(l) + carbonato de cálcio --->hidrogenocarbonato de cálcio(aq)
À medida que a solução escorre na gruta, a água evapora-se e ocorre a operação inversa, o hidrogenocarbonato de cálcio transforma-se em carbonato de cálcio.
hidrogenocarbonato de cálcio(aq) --->dióxido de carbono(g) + água(g) + carbonato de cálcio(s)
O carbonato de cálcio é pouco solúvel em água e precepita, formando as estalactites e as estalagmites.
Ocorrem reações de precipitação.

Estruturas pendentes do teto - estalactites
Estruturas pendentes do solo - estalagmites
Dióxido de carbono no ar dissolve-se na água e forma as chuvas ácidas.
Água da chuva reage com o carbonato de cálcio (constituinte do calcário), na gruta, e forma hidrogenocarbonato de cálcio que fica dissolvido na água.
dióxido de carbono(g) + água(l) + carbonato de cálcio --->hidrogenocarbonato de cálcio(aq)
À medida que a solução escorre na gruta, a água evapora-se e ocorre a operação inversa, o hidrogenocarbonato de cálcio transforma-se em carbonato de cálcio.
hidrogenocarbonato de cálcio(aq) --->dióxido de carbono(g) + água(g) + carbonato de cálcio(s)
O carbonato de cálcio é pouco solúvel em água e precepita, formando as estalactites e as estalagmites.
Ocorrem reações de precipitação.
Reações de precipitação
Esquemas de palavras:
nitrato de chumbo (aq) + iodeto de potássio (aq) ---->
iodeto de chumbo (s) (precipitado amarelo) + nitrato de potássio (aq)
cloreto de sódio(aq) + nitrato de prata (aq) ---->
cloreto de prata (s) (precipitado branco) + nitrato de sódio (aq)
hidróxido de sódio (aq) + sulfato de cobre (aq) ---->
hidróxido de cobre (s) (precipitado azul) + sulfato de cobre (aq)
segunda-feira, 19 de novembro de 2012
Reações ácido-base
Anti-ácidos
Medicamentos para combater a azia (bases) - reduzem o ácido no estômago.
Bases e ácidos combinam-se:
São reações entre um ácido e uma base
Produtos de reação - água e sal
Medicamentos para combater a azia (bases) - reduzem o ácido no estômago.
Bases e ácidos combinam-se:
- novas substâncias
- solução menos ácida
- Se juntar-mos ainda mais base, a solução pode tornar-se básica.
São reações entre um ácido e uma base
Produtos de reação - água e sal
ácido + base ----> água + sal - reação ácido base
EXEMPLOS:
ácido sulfúrico + hidróxido de potássio ----> água + sulfato de potássio
ácido clorídico + hidróxido de sódio ----> água + cloreto de sódio
Legenda:
Rosa - ácido
Verde - base
Azul - sal
PH das soluções
O que é o PH?
É uma escala que permite avaliar a menor ou maior acidez ou basicidade das soluções.
Soluções ácidas - PH < 7
Quanto mais baixo, mais ácida é a solução.
Soluções neutras - PH = 7
Soluções básicas - PH > 7
Quanto mais alto, mais básica ou alcalina é a solução.


É uma escala que permite avaliar a menor ou maior acidez ou basicidade das soluções.
Soluções ácidas - PH < 7
Quanto mais baixo, mais ácida é a solução.
Soluções neutras - PH = 7
Soluções básicas - PH > 7
Quanto mais alto, mais básica ou alcalina é a solução.

Como se determina?
Indicadores ácido-base
Indicadores ácido-base
São substâncias que mudam de cor consoante o carácter químico das soluções, portanto, que o identificam.
 Os indicadores mais usados nas escolas:
Os indicadores mais usados nas escolas:
São substâncias que mudam de cor consoante o carácter químico das soluções, portanto, que o identificam.
- Tintura azul de tornesol (azul arroxeado)
- Solução alcoólica de fenolftaleína (incolor)
- Soluções básicas : fica carmim
- Soluções neutras: mantém-se incolor
- Soluções ácidas: mantém-se incolor
- Soluções básicas: mantém-se azul arroxeado
- Soluções neutras: mantém-se azul arroxeado
- Soluções ácidas: fica vermelho
Carácter químico das soluções
Soluções ácidas, básicas ou neutras
Soluções ácidas
Características:



Soluções ácidas
Características:
- São azedas/os
- Reagem com certos metais
- Conduzem a eletrecidade
- Alteram a cor de alguns corantes naturais/sintéticos
- Maçãs - ácido málico
- Citrinos - ácido cítrico
- Uvas - ácido tartárico
- Vinagre - ácido acético
- Pepsi e coca-cola - ácido fosfórico
Soluções básicas ou alcalinas
Características:
- sabor amargo;
- escorregadias ao tato;
- conduzem a eletrecidade;
- alteram a cor de certos corantes naturais;
- detergentes - amoníaco (base)
- Lixívia - hipoclorito de sódio (base)
- Pasta de dentes
- Anti-ácido
- hidróxidos de sódio, cálcio e potássio (bases)
Soluções neutras
Soluções que não são ácidas nem básicas. Tem um carácter químico neutro.
EXEMPLOS:
- Água
- Sal e açúcar
- Água destilada
Corrosão
Corrosão
O que é?
A corrosão é o processo de deterioração dos materiais nomeadamente dos metais.
Exemplo: A corrosão do ferro é a formação de ferrugem que consiste na reação do metal com o oxigénio mais a água que forma óxido de ferro hidratado - a conhecida ferrugem.
Equação de palavras:
Ferro (s) + oxigénio (g) + água (g) ----> óxido de ferro hidratado (ferrugem)
Como se pode evitar?
Pode evitar-se com a pintura (tintas próprias) ou cobertura com metais que não formam óxido quando reagem com o óxigénio.
O que é?
A corrosão é o processo de deterioração dos materiais nomeadamente dos metais.
Exemplo: A corrosão do ferro é a formação de ferrugem que consiste na reação do metal com o oxigénio mais a água que forma óxido de ferro hidratado - a conhecida ferrugem.
Equação de palavras:
Ferro (s) + oxigénio (g) + água (g) ----> óxido de ferro hidratado (ferrugem)
Como se pode evitar?
Pode evitar-se com a pintura (tintas próprias) ou cobertura com metais que não formam óxido quando reagem com o óxigénio.
domingo, 18 de novembro de 2012
Combustão do sódio
Combustão do sódio
sódio(s) + oxigénio (g) ----> óxido de sódio (s) + energia
ou
sódio(s) + oxigénio (g) ----> peróxido de sódio (s) + energia

sódio(s) + oxigénio (g) ----> óxido de sódio (s) + energia
ou
sódio(s) + oxigénio (g) ----> peróxido de sódio (s) + energia
Combustão do enxofre
Combustão do enxofre
enxofre(s) + oxigénio (g) ----> dióxido de enxofre (g) + energia
ou
enxofre(s) + oxigénio (g) ----> trióxido de enxofre (g) + energia

enxofre(s) + oxigénio (g) ----> dióxido de enxofre (g) + energia
ou
enxofre(s) + oxigénio (g) ----> trióxido de enxofre (g) + energia
sábado, 17 de novembro de 2012
Combustão do magnésio
Combustão do magnésio
Magnésio(s) + oxigénio (g) ----> óxido de magnésio(s) + energia

Magnésio(s) + oxigénio (g) ----> óxido de magnésio(s) + energia
Combustão do carbono
Combustão do carbono
Carbono(s) + oxigénio(g) ----> Dióxido de carbono (g) + energia (combustão completa)
Se a reação tiver uma baixa concentração em oxigénio:
Carbono(s) + oxigénio(g) ----> Monóxido de carbono (g) + energia (combustão incompleta)
Carbono(s) + oxigénio(g) ----> Dióxido de carbono (g) + energia (combustão completa)
Se a reação tiver uma baixa concentração em oxigénio:
Carbono(s) + oxigénio(g) ----> Monóxido de carbono (g) + energia (combustão incompleta)
Diferença entre combustões lentas e vivas
Qual a diferença entre combustões vivas e lentas?
É verdade, as combustões não originam todas fogo ou chama. A estas combustões em que não há formação de chama, dá-se o nome de combustões lentas. Às que há chamam-se combustões vivas. Exemplos de combustões lentas são o enferrojamento do ferro (corrosão) e a respiração celular.

É verdade, as combustões não originam todas fogo ou chama. A estas combustões em que não há formação de chama, dá-se o nome de combustões lentas. Às que há chamam-se combustões vivas. Exemplos de combustões lentas são o enferrojamento do ferro (corrosão) e a respiração celular.
Reações de combustão
Numa combustão há sempre:



Também há sempre uma fonte de ignição ou energia de ativação.
Há sempre libertação de calor ou luz e formação de óxidos (produtos de reacção)

terça-feira, 13 de novembro de 2012
Transformações físicas e químicas
Transformações físicas e químicas
O que são? Qual a diferença?
Nas transformações químicas ocorre a formação de novas substâncias e nas transformações físicas não. As transformações químicas podem ser chamadas também de reações químicas.
Exemplo:
Uma folha de papel:
Transformação química: Queimar a folha;
Transformação física: Dobrar, rasgar a folha;
Detetar uma reação química:
- alteração de cor;
- variação da temperatura;
- variação de volume;
- libertação de um gás;
- aparecimento/desaparecimento de um sólido;
As reações químicas são descritas pelos esquemas/equações de palavras.
Substâncias iniciais - reagentes
Substâncias obtidas após a transformação - produtos de reação
O que são? Qual a diferença?
Nas transformações químicas ocorre a formação de novas substâncias e nas transformações físicas não. As transformações químicas podem ser chamadas também de reações químicas.
Exemplo:
Uma folha de papel:
Transformação física: Dobrar, rasgar a folha;
Detetar uma reação química:
- alteração de cor;
- variação da temperatura;
- variação de volume;
- libertação de um gás;
- aparecimento/desaparecimento de um sólido;
As reações químicas são descritas pelos esquemas/equações de palavras.
Substâncias iniciais - reagentes
Substâncias obtidas após a transformação - produtos de reação
quinta-feira, 1 de novembro de 2012
Separações fisicas de misturas de substâncias
Separações de misturas de substâncias
Separação de misturas heterogéneas

Peneiração
Técnica de separação utilizada para separar partículas com tamanhos diferentes. Recorre-se à utilização de peneiros. A rede retém as maiores partículas e deixa passar as menores.
Exemplo: Peneiração da farinha e separação de pedras da areia do rio.

Separação magnética
Processo utilizado quando um componente da mistura possui propriedades magnéticas.O ferro é atraído pelo íman separando-se dos outros componentes da mistura.

Sublimação
Técnica que se utiliza para separar uma substância sólida que sublime facilmente. Depois do iodo sublimar (gasoso-sólido), quando chega à superfície fria, sublima de novo (sólido- gasoso) e ficamos com este retido.

Decantação
Separação de partículas sólidas de um líquido. Com o auxílio da vareta, transfere-se o líquido para outro recipiente. É claro que acabam sempre por ficar partículas com menos densidade no líquido que depois são retiradas com outro processo denominado filtração.

Filtração
Processo que também permite a separação de um sólido de um líquido fazendo-o passar por um filtro, onde as partículas sólidas (resíduo) ficam no papel e o líquido passa pelos poros e entra no outro recipiente. É necessário ter um funil.

Centrifugação
Este processo também permite separar,através da rotação a grande velocidade da mistura na centrifugadora, as partículas sólidas de pequenas dimensões que se encontram no líquido.

Decantação com funil/ampola de decantação
Separação de misturas homogéneas
 Ebulição do solvente
Ebulição do solvente

Destilação simples

Destilação fracionada
Cristalização
Processo utilizado para recuperar os cristais de um dado sólido dissolvido num determinado líquido. Realiza-se por evaporação lenta do solvente. À medida que este se evapora, os cristais vão-se separando da mistura. Quanto mais demorada for a cristalização, maiores e mais fortes vão ser os cristais.

Cromatografia
Técnica utilizada quando existem amostras de mistura e as substâncias têm diferentes capacidades de se fixar num sólido. Coloca-se uma mistura sobre o papel e mergulha-se no solvente, verificando que as substâncias da mistura são arrastadas para diferentes zonas do papel de filtro - obtém-se o cromatograma.
Separação de misturas heterogéneas
Peneiração
Técnica de separação utilizada para separar partículas com tamanhos diferentes. Recorre-se à utilização de peneiros. A rede retém as maiores partículas e deixa passar as menores.
Exemplo: Peneiração da farinha e separação de pedras da areia do rio.
Separação magnética
Processo utilizado quando um componente da mistura possui propriedades magnéticas.O ferro é atraído pelo íman separando-se dos outros componentes da mistura.

Sublimação
Técnica que se utiliza para separar uma substância sólida que sublime facilmente. Depois do iodo sublimar (gasoso-sólido), quando chega à superfície fria, sublima de novo (sólido- gasoso) e ficamos com este retido.
Decantação
Separação de partículas sólidas de um líquido. Com o auxílio da vareta, transfere-se o líquido para outro recipiente. É claro que acabam sempre por ficar partículas com menos densidade no líquido que depois são retiradas com outro processo denominado filtração.
Filtração
Processo que também permite a separação de um sólido de um líquido fazendo-o passar por um filtro, onde as partículas sólidas (resíduo) ficam no papel e o líquido passa pelos poros e entra no outro recipiente. É necessário ter um funil.
Centrifugação
Este processo também permite separar,através da rotação a grande velocidade da mistura na centrifugadora, as partículas sólidas de pequenas dimensões que se encontram no líquido.
Decantação com funil/ampola de decantação
Permite a separação de dois líquidos imiscíveis. coloca-se a mistura no funil e deixa-se repousar para o líquido com mais densidade ficar em cima e o de menor densidade ficar em baixo. Separa-se os líquidos abrindo e fechando a torneira do funil de decantação.
Separação de misturas homogéneas
Técnica de separação que permite a recuperação de um sólido dissolvido num líquido.
Aquece-se a solução de forma a que ocorra a ebulição do solvente. Para obter os cristais do sólido é mais fácil que a cristalização.
Destilação simples
Técnica de separação que consiste na ebulição de uma mistura do estado líquido, seguida da condensação dos vapores.
Para a destilação ser bem feita é necessário que os pontos de ebulição dos líquidos sejam diferentes.
Destilação fracionada
Processo utilizado na separação de dois ou mais líquidos com pontos de ebulição muito próximos. Os valores do líquido que tem menor ponto de ebulição chegam ao topo da coluna mais rapidamente - primeiro liquido a destilar. Os outros líquidos destilam por ordem crescente dos seus pontos de ebulição.
Exemplo: separação dos componentes do petróleo.Cristalização
Processo utilizado para recuperar os cristais de um dado sólido dissolvido num determinado líquido. Realiza-se por evaporação lenta do solvente. À medida que este se evapora, os cristais vão-se separando da mistura. Quanto mais demorada for a cristalização, maiores e mais fortes vão ser os cristais.

Cromatografia
Técnica utilizada quando existem amostras de mistura e as substâncias têm diferentes capacidades de se fixar num sólido. Coloca-se uma mistura sobre o papel e mergulha-se no solvente, verificando que as substâncias da mistura são arrastadas para diferentes zonas do papel de filtro - obtém-se o cromatograma.
Subscrever:
Comentários (Atom)